JCIM | MD揭示PTP1B磷酸酶激活RtcB连接酶的机制

Background
内质网应激反应(UPR) 中的一个重要过程。UPR是由内质网中的三种跨膜传感器(IRE1、PERK和ATF6)控制的细胞应激反应,当内质网中的蛋白质折叠能力受到压力时,UPR通过减少蛋白质合成和增加未折叠或错误折叠蛋白质的分泌和降解来恢复细胞稳态。RtcB连接酶在IRE1介导的XBP1 mRNA剪切中起着关键作用,通过连接两个外显子形成XBP1s剪接异构体,进而激活与内质网相关降解相关的基因转录。此研究使用了多种计算方法,包括蛋白质-蛋白质对接、量子力学/分子力学(QM/MM)模拟和经典分子动力学(cMD)模拟。

Highlights
- 蛋白质-蛋白质对接:揭示了RtcB和PTP1B之间的关键相互作用残基,特别是磷酸化的Tyr306与PTP1B的Arg47和Lys120形成氢键和盐桥相互作用。
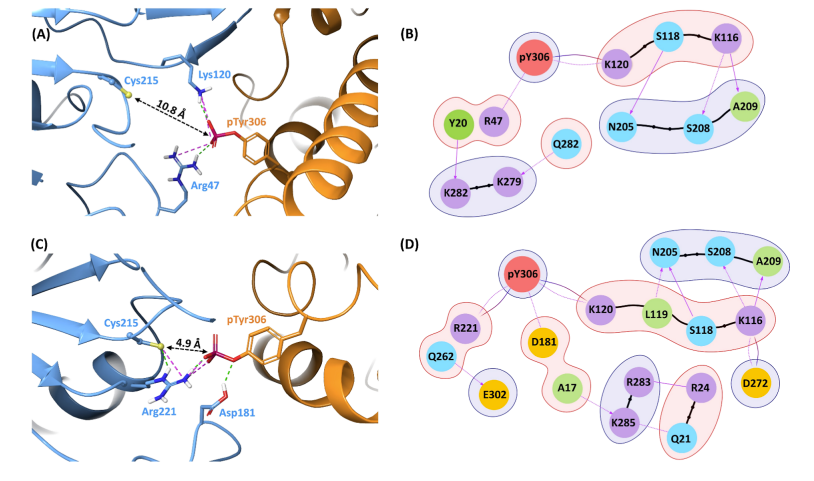
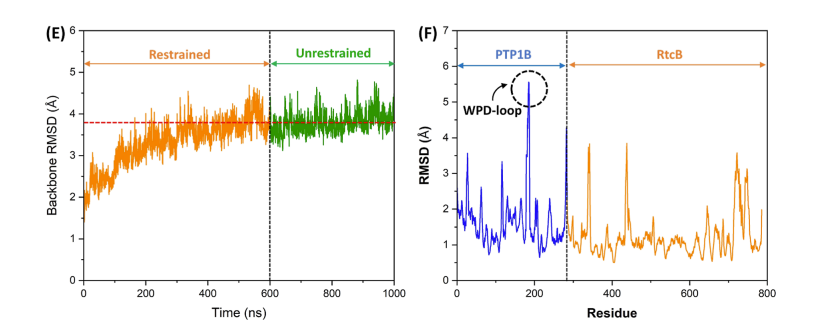
- 经典MD模拟:强调了Asp181在PTP1B激活中的关键作用,它驱动了WPD环从开放到闭合的构象变化。
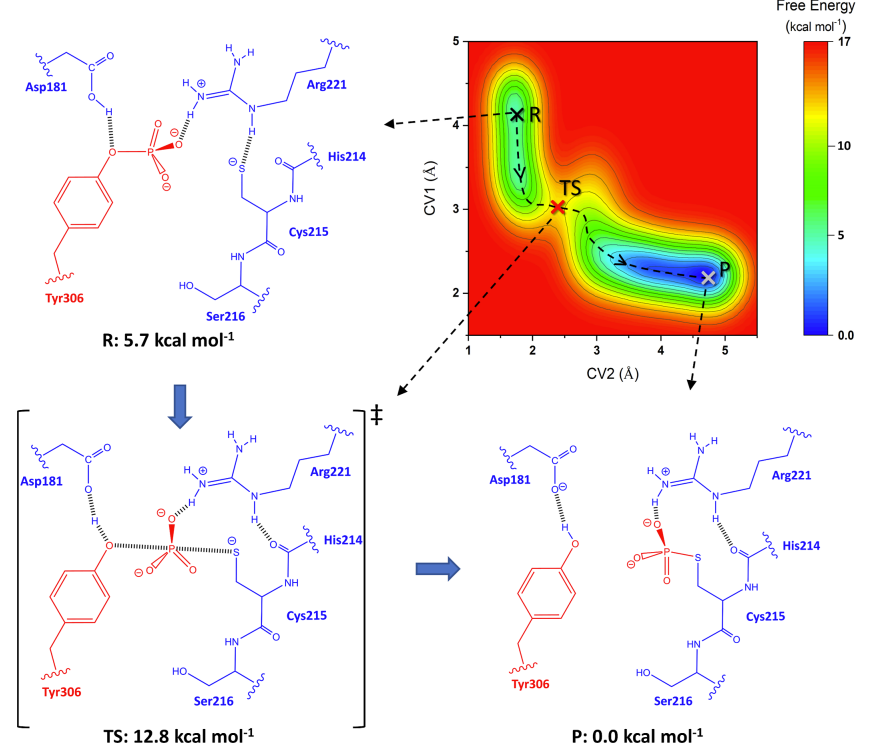
- QM/MM-MD模拟:提供了RtcB去磷酸化反应机制的自由能景观,该反应由PTP1B磷酸酶介导。
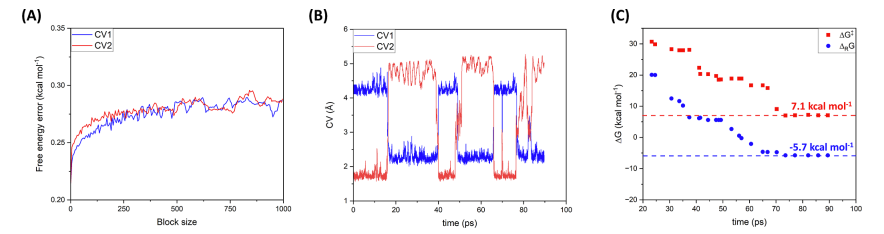
- 计算资源和性能:QM/MM WT-MetaD模拟在Dardel超级计算机上进行,展示了模拟的计算效率。
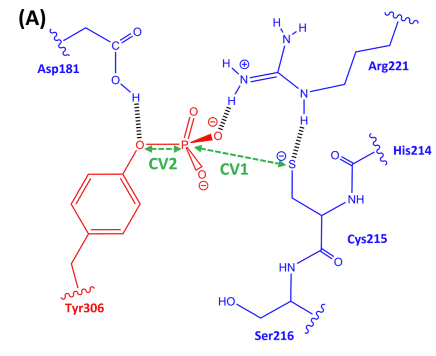
研究揭示了PTP1B的WPD环(残基179-187)在催化活性中的作用,特别是Asp181在反应的第一步和第二步中分别作为广义酸和广义碱。研究还探讨了Asp181在活性和非活性状态下的局部化学微环境对其pKa值的影响。这项研究为理解UPR中RtcB连接酶的激活机制提供了新的见解,并可能为治疗与内质网应激相关的疾病提供新的策略。